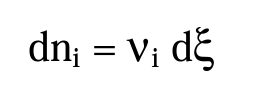
Attività 3.2: la velocità di reazione di una miscela
La velocità di reazione di una miscela
Come misura della velocità di reazione si assume la diminuzione della concentrazione di uno dei reagenti o l’aumento della quantità di uno di prodotti per unità di tempo.[br]La velocità di reazione può essere definita anche in termini di [b]grado di avanzamento[/b] della reazione ξ. Il grado di avanzamento permette di esprime [b]la variazione nel corso della reazione del numero di moli della specie i-esima [/b]come:[br]
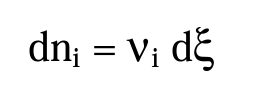
dove dni è la variazione infinitesima del numero di moli del componente i-esimo, νi è il coefficiente stechiometrico della specie i-esima e dξ la variazione infinitesima del grado di avanzamento della reazione. La velocità di reazione può essere definita allora come:
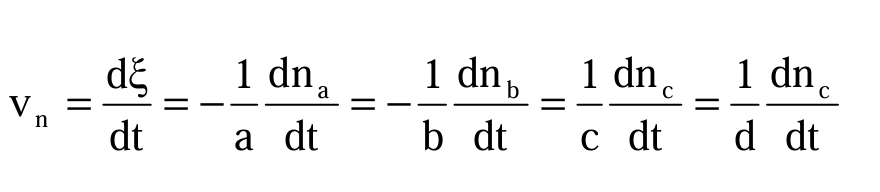
Questa equazione è la più generale in quanto esprime la velocità di reazione come derivata del numero di moli dei vari componenti rispetto al tempo e può essere applicata a sistemi eterogenei costituiti da due o più fasi.
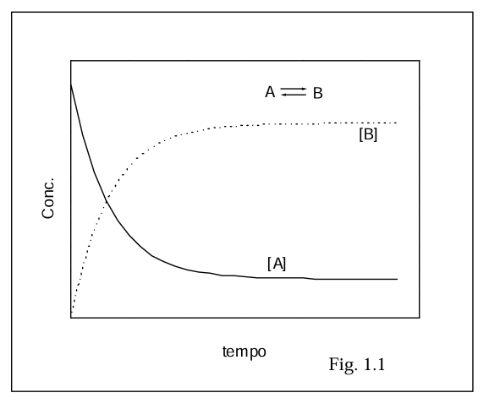
È possibile dedurre il grafico delle velocità di reazione di una miscela?
Conoscendo l'andamento delle variazioni delle concentrazioni di elementi di una miscela, è possibile dedurre il grafico della velocità di reazione?[br]Se sì, come?
Esercizio
Deduci il grafico delle velocità di reazione dei due reagenti A e B, conoscendo il grafico delle variazioni di concentrazione